再生・細胞医療・遺伝子治療について
再生・細胞医療・遺伝子治療は、怪我や病気で失われた体の細胞や機能を回復する次世代の治療であり、これまで根治が難しかった疾患を治療しうる技術として世界的に大きな期待を寄せられる分野です。市場も急速に拡大しており、特に、細胞・遺伝子治療の市場に関しては、2030年まで年率30%以上の成長率で拡大することを見込まれるなど、産業上の重要性も高い分野であると言えます。一方で、実用化にあたっては、安全性や製造技術等に関する技術的課題や、研究開発にかかるコストや費用が大きいことによる社会的課題、この分野の実態に沿った規制・制度の整備などの法的課題、基礎研究の更なる充実の必要性など、様々な課題が存在します。
政府としては、日本医療研究開発機構(AMED)を一元的な執行機関とし、文部科学省、厚生労働省、経済産業省で連携をしながら、再生医療の実用化に取り組んできました。中でも経済産業省では、再生・細胞医療・遺伝子治療の産業化に向けて、基盤となる製造技術の開発や、原料供給等のサプライチェーンの整備等に取り組んでおります。
令和5年度当初予算「再生医療・遺伝子治療の産業化に向けた基盤技術開発事業」
PR資料※各プロジェクトの公募情報・詳細についてはこちらをご覧ください。
AMED 再生・細胞医療・遺伝子治療事業部の事業一覧
ヒト細胞加工製品製造基盤技術開発
従来の工業製品の製造法であるQbT(Quality by Testing)は単品生産・単品検査の方式で、原料細胞のばらつきが大きく、品質評価が難しい再生医療の分野においてこの方式で生産を行うと、製造効率・歩留まりが低く留まってしまいます。この事業では、QbD(Quality by Design)の考え方に基づき、各製造工程における重要なパラメーターと品質特性を特定して工程をモニタリングして品質をコントロールする手法を開発し、高品質・高均質の再生医療等製品を効率的に製造できる技術基盤を確立します。 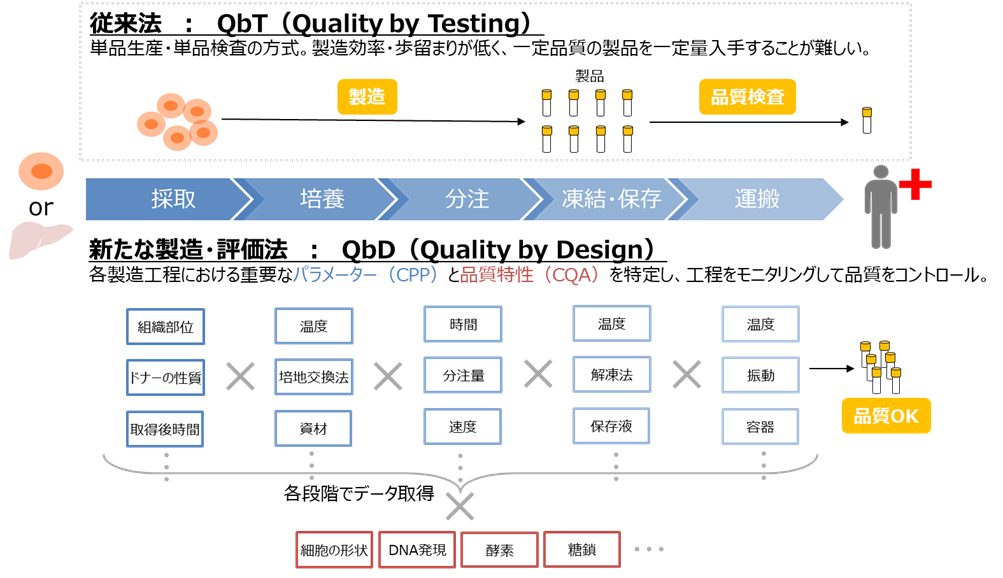
【関連情報】
細胞製造コトづくり拠点
細胞製造に関する共通および固有の概念・技術を構築するため、本事業において、細胞を安心・安定・安価に製造するための細胞製造の技術開発(モノづくり)や必要不可欠な規制や国際標準化の構築(ルールづくり),センス良い人材の育成(ヒトづくり)に取り組んでいます。
再生医療用原料細胞安定供給研究開発
再生医療の原料となる細胞に関しては、医療機関において採取された細胞を適切に保管・運搬し、再生医療等製品の製造販売事業者に提供される必要がありますが、国内では未だこの供給体制の確立や法的・倫理的・社会的な課題の解決が十分ではありません。この事業では、品質の確保された原料細胞の採取・運搬等に係る仕組みの構築やそのための手順明確化等に関する実証研究等を行います。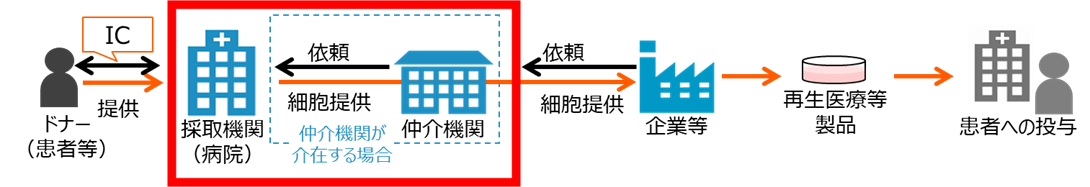
【関連情報】
ヒト(同種)細胞原料供給に係るガイダンス 第3版
本ガイダンスは、ヒト細胞原料の供給を目指す医療機関等及び、これを利用して再生医療等製品の製造を目指す企業等を支援するため、安定的なヒト細胞原料の供給及びトレーサビリティの確保、供給体制の持続可能な運営を可能とするための法的・倫理的・社会的な側面について検討・整理したものです。実務の参考として活用ください。 (附属資料)ヒト(同種)細胞原料供給に係るガイダンスにおける留意点
本留意点文書は、安定供給促進事業に採択された実施機関が、現時点において共通して達成可能な作業手順及び品質水準、並びに留意点を共有することで、国内のヒト細胞原料の供給に当たり、品質や手続きの一貫性と向上を目指すことに寄与することを目的として、安定供給促進事業において、ガイダンスの附属資料として取りまとめたものです。ガイダンスと合わせて、実務の参考として活用ください。
高度創薬支援ツール基盤技術開発
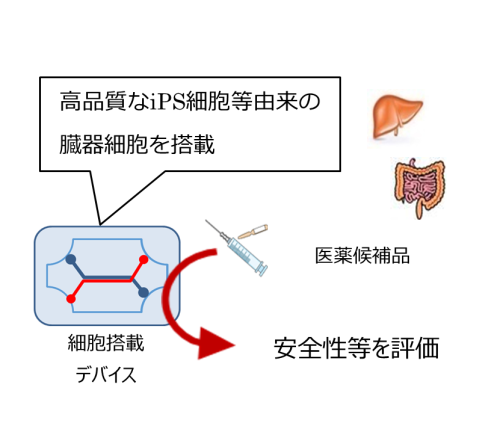
再生医療は、臨床現場の新たな治療の選択肢となるのみならず、動物実験の代替や新規モダリティの評価等を可能とする創薬支援ツールとしての応用が期待されています。現在、新たなモダリティの登場に伴う医薬品の安全性や有効性に関する適切な評価が難しくなっている、また、動物倫理の観点や新型コロナウイルス感染症拡大に伴う世界的な実験動物の不足により動物実験の実施が難しくなってきているといった、非臨床試験における課題が顕在化しています。本事業では、高品質のiPS細胞等から分化誘導される各種臓器の細胞等を用いた創薬支援ツールを開発します。
遺伝子治療製造技術開発
遺伝子治療で必要となるウイルスベクター(遺伝子の運び屋)を大量に生産する技術が日本では確立されておらず、必要な原料・技術を海外に頼らざるを得ない状況となっております。本事業では、高品質で安全性の高い治療用ベクターの製造・評価技術等を開発するほか、ベクター製造のプラットフォームを構築し、非臨床・臨床試験までの一貫した製造に取り組み、国内の遺伝子治療薬製造のための基盤を確立します。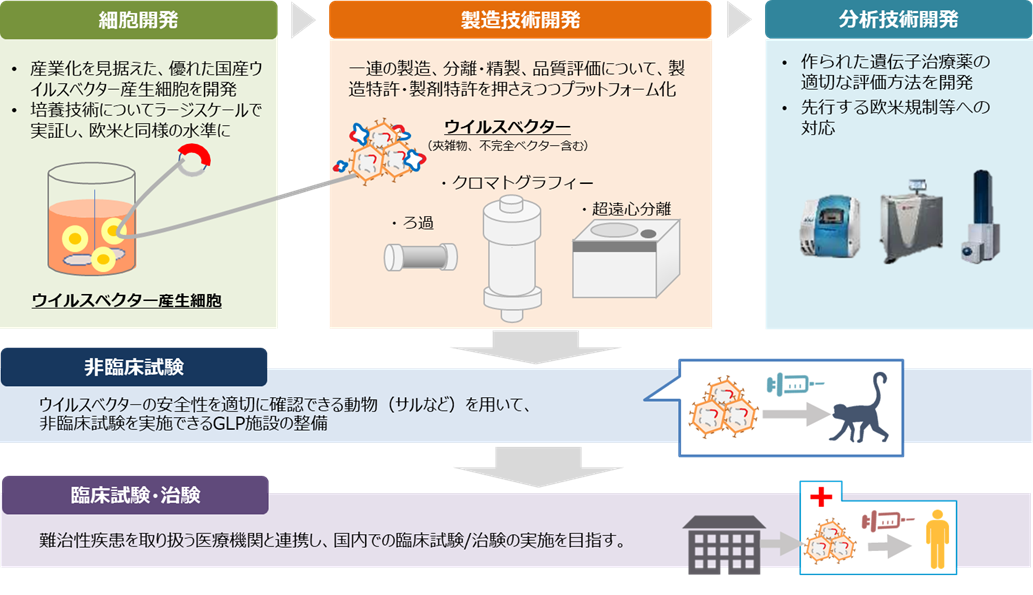
【関連情報】
次世代バイオ医薬品製造技術研究組合
次世代バイオ医薬品製造技術研究組合は、本事業において、遺伝子・細胞治療用ベクター等の大量製造に対応するため、国内の関連技術を保有する産官学が結集し、治験等の実施に向けての規制への対応まで想定した要素技術の開発及び製造技術プラットフォームの構築を目指しています。
産業化促進研究開発
実用化を目指す有望な再生医療等製品シーズの、迅速な知見へ向けた製品開発(製造プロセス構築等)を補助し、産業化を加速します。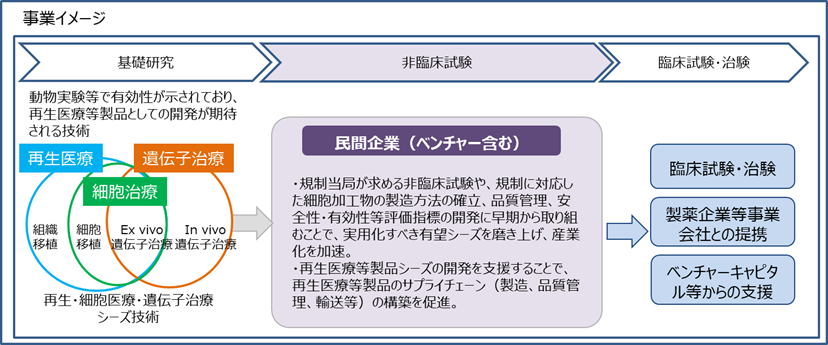
令和4年度補正予算「再生・細胞医療・遺伝子治療の社会実装に向けた環境整備」
PR資料
再生・細胞医療・遺伝子治療は、これまで根治が難しかった疾患を治療しうる技術として、世界的に大きな期待が寄せられている分野であり、新たな市場を形成しつつあります。一方、ヒトへの投与まで至ったパイプラインの中でも
①薬機法下で承認を得たものの適応症や患者数が限定的となり、優れた技術を持っていても十分な収益が得られない、あるいは条件期限付承認後に十分なエビデンスを確立できない
②再生医療等提供計画の下で提供されているが、患者にとってのメリットや治療効果の検証が必ずしも十分でない
といった課題を抱え、社会実装が進んでいないケースも存在し、その後のフェーズでも取り組むべき課題が存在しています。
①薬機法下で承認を得たものの適応症や患者数が限定的となり、優れた技術を持っていても十分な収益が得られない、あるいは条件期限付承認後に十分なエビデンスを確立できない
②再生医療等提供計画の下で提供されているが、患者にとってのメリットや治療効果の検証が必ずしも十分でない
といった課題を抱え、社会実装が進んでいないケースも存在し、その後のフェーズでも取り組むべき課題が存在しています。
こうした現状を解決し、再生医療等の研究開発・実用化を持続的に推進するには、適切な品質保証や培養加工体制の下で再生医療等の提供を拡大し、自立した産業化を目指すことが重要です。
本事業は、再生・細胞医療・遺伝子治療の提供を国内外に適切に拡大していけるよう、治療効果を科学的・客観的データによって確立するための一貫した提供体制(原材料確保・製造・品質評価・運搬・臨床)や、各過程において科学的・客観的データを収集し品質の担保・改善に繋げるシステムの構築を促進することを目的としています。
※本事業の詳細については事務局HPをご覧ください。
事務局(株式会社シード・プランニング)HP
本事業は、再生・細胞医療・遺伝子治療の提供を国内外に適切に拡大していけるよう、治療効果を科学的・客観的データによって確立するための一貫した提供体制(原材料確保・製造・品質評価・運搬・臨床)や、各過程において科学的・客観的データを収集し品質の担保・改善に繋げるシステムの構築を促進することを目的としています。
※本事業の詳細については事務局HPをご覧ください。
事務局(株式会社シード・プランニング)HP
その他関連施策
生物化学産業課が行う再生・細胞医療・遺伝子治療に関する取組のほかに、この分野に関わる企業・研究者の皆様が利用できる可能性の高い支援策として、以下のような施策があります。再生医療に限定した支援策以外にも、中小企業を対象にした補助金や相談窓口なども活用いただけるケースがあります。
中小企業向け補助金・総合支援サイト「ミラサポplus」では、中小企業支援施策(制度)の検索や、各制度の内容・申請方法等の確認ができますので、ぜひご参照ください。
関連調査・ガイダンス
全般
本調査は、再生医療および遺伝子治療領域の国内外の研究開発動向や製品化動向を調査・分析し、その他の医療技術との競合状況を踏まえた上で、国内外の再生医療および遺伝子治療領域の市場調査と市場予測を実施し、再生医療および遺伝子治療の産業化将来予測および市場獲得のためのシナリオを提示し、我が国の当該分野発展のための施策・支援のあり方を検討したものです。MPS(Microphysiological System)関連
本調査は、医薬品の動物実験代替試験ならびにヒト細胞を用いるより精度の高い前臨床試験の代替として注目されている MPS(Microphysiological System) について、標準化、規制・基準、そして競合品の動向調査を実施し、制度及び、技術的課題、国際市場の分析をもとに、日本のMPS がグローバルシェアを獲得するために必要な取組について検討したものです。ヒト細胞原料関連
- ヒト(同種)細胞原料供給に係るガイダンス 第3版
- (附属資料)ヒト(同種)細胞原料供給に係るガイダンスにおける留意点
本報告書は、「再生医療等製品用ヒト(同種)体性幹細胞原料の安定供給促進事業」における、令和4年度の調査・議論の内容をとりまとめたものです。具体的には、各実施機関が個別に作成する作業手順書を踏まえたスタンダードの作成や、製薬企業をはじめとするクライアント企業がヒト(同種)体性幹細胞原料を取得する際のニーズ等について、有識者、実施機関、関連学会、関連団体等により調査・議論した内容をまとめています。
再生医療等製品の開発・実用化には、その原料となるヒト(同種)細胞の安定的な供給の促進が必要不可欠であり、そのためには採取の場となる医療機関や採取した細胞を仲介する仲介機関に向けて基本的な作業手順等を共通化することが重要であることから、経済産業省では「再生医療等製品用ヒト(同種)体性幹細胞原料の安定供給促進事業」にて、標準的な手順書の策定に取り組んでいます。
本調査は、上記事業の成果を国際的なルールに反映していくため、ヒト(同種)細胞に関する世界各国での品質基準・審査 体制の整備・検討状況や規制・制度の調査を行い、我が国のヒト細胞原料及び再生医療等製品が国際的に適切に評価される環境の整備に向けて必要な取組について検討したものです。
関連する議論・会議等
- 健康・医療戦略推進本部(内閣府)
- 厚生科学審議会(再生医療等評価部会)(厚生労働省)
- 再生・細胞医療・遺伝子治療研究の在り方に係る検討会(文部科学省)
お問合せ先
商務・サービスグループ 生物化学産業課電話:03-3501-1511(代表)
FAX:03-3501-0197
最終更新日:2024年5月23日